เอนไซม์
นิยาม
เอนไซม์เป็นสารเคมีที่สามารถพบได้ทั่วร่างกาย พวกเขาตั้งปฏิกิริยาทางเคมีในการเคลื่อนไหวในร่างกาย
ประวัติศาสตร์
คำ เอนไซม์ ทำโดย วิลเฮล์มฟรีดริชคูห์น 2421 และมาจากคำที่สร้างขึ้นในภาษากรีกซึ่งหมายถึงยีสต์หรือ sourdough จากนั้นก็ค้นพบทางเข้าสู่วิทยาศาสตร์สากล สหภาพระหว่างประเทศของเคมีประยุกต์บริสุทธิ์ (IUPAC) และ สหภาพชีวเคมีระหว่างประเทศ (IUBMB) ทำงานร่วมกันเพื่อพัฒนาระบบการตั้งชื่อสำหรับเอนไซม์ที่กำหนดตัวแทนของสารกลุ่มใหญ่นี้เป็นกลุ่มทั่วไป การตั้งชื่อซึ่งแบ่งประเภทของเอนไซม์ตามลักษณะงานมีความสำคัญต่อการกำหนดงานของเอนไซม์แต่ละชนิด
ภาพประกอบของเอนไซม์
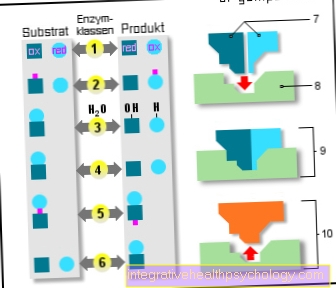
เอนไซม์
เอนไซม์ 6 คลาส:
- ออกซิโดรีดักเตส
(ออกซิเดชั่น / รีดิวซ์) - การโอน
(การแพร่เชื้อ) - ไฮโดรเลส
(การใช้น้ำ) - ไลแอส
(ความแตกแยก) - ไอโซเมอเรส
(สูตรเชิงประจักษ์เดียวกัน) - ลิกาส
(ปฏิกิริยาเพิ่มเติม) - พื้นผิว
- ศูนย์ที่ใช้งานอยู่
- เอนไซม์ / สารตั้งต้น
ซับซ้อน - เอนไซม์ / ผลิตภัณฑ์
ซับซ้อน
ภาพรวมของทั้งหมดรูปภาพของเขาโดย Dr-Gumpert สามารถพบได้ที่: ภาพประกอบทางการแพทย์
การตั้งชื่อ
การตั้งชื่อ เอนไซม์เปิดอยู่ หลักการพื้นฐานสามประการ ซึ่งเป็นรากฐาน. ชื่อเอนไซม์ที่ลงท้ายด้วย –ase อธิบายถึงเอนไซม์หลายชนิดในระบบ ชื่อเอนไซม์นั้นอธิบายถึงปฏิกิริยาที่เอนไซม์ตั้งค่าในการเคลื่อนที่ (เร่งปฏิกิริยา). ชื่อเอนไซม์ยังเป็นการจำแนกประเภทของเอนไซม์ นอกจากนี้ระบบรหัสที่ ระบบเลข ECซึ่งเอนไซม์ถูกสร้างขึ้นภายใต้รหัสตัวเลข ตัวเลขสี่ตัว สามารถพบได้ ตัวเลขแรกระบุระดับเอนไซม์ รายชื่อเอนไซม์ที่ตรวจพบทั้งหมดช่วยให้มั่นใจได้ว่ารหัสเอนไซม์ที่ระบุสามารถพบได้เร็วขึ้น แม้ว่ารหัสจะขึ้นอยู่กับคุณสมบัติของปฏิกิริยาที่เอนไซม์เร่งปฏิกิริยา แต่ในทางปฏิบัติรหัสตัวเลขพิสูจน์แล้วว่าไม่สามารถทำได้ ชื่อที่เป็นระบบตามกฎข้างต้นถูกใช้บ่อยขึ้น ปัญหาเกี่ยวกับระบบการตั้งชื่อเกิดขึ้นเช่นกับเอนไซม์ที่กระตุ้นปฏิกิริยาต่างๆ ดังนั้นบางครั้งจึงมีหลายชื่อสำหรับพวกเขา เอนไซม์บางชนิดมีชื่อที่ไม่สำคัญซึ่งไม่ได้ระบุว่าสารที่กล่าวถึงเป็นเอนไซม์ เนื่องจากชื่อนี้มีการใช้กันอย่างแพร่หลายบางส่วนจึงถูกเก็บรักษาไว้
การจำแนกตามการทำงานของเอนไซม์
ตาม IUPAC และ IUBMB เอนไซม์แบ่งออกเป็นหกชั้นเอนไซม์ตามปฏิกิริยาที่พวกมันกำหนดในการเคลื่อนที่:
- ออกซิโดรีดักเตส
Oxidoreductases ตั้งค่าปฏิกิริยารีดอกซ์ในการเคลื่อนที่ ในปฏิกิริยาเคมีนี้อิเล็กตรอนจะถูกถ่ายโอนจากคู่ปฏิกิริยาหนึ่งไปยังอีกคู่หนึ่ง สารชนิดหนึ่งปล่อยอิเล็กตรอน (ออกซิเดชั่น) และอีกสารหนึ่งรับอิเล็กตรอน (รีดักชัน)
สูตรสำหรับปฏิกิริยาที่เร่งปฏิกิริยาคือ A ?? + B? A? + B?
สาร A ปลดปล่อยอิเล็กตรอน (?) และถูกออกซิไดซ์ในขณะที่สาร B ดูดซับอิเล็กตรอนนี้และถูกลดจำนวนลง นี่คือสาเหตุที่ปฏิกิริยารีดอกซ์เรียกอีกอย่างว่าปฏิกิริยารีดักชัน - ออกซิเดชั่น
ปฏิกิริยาการเผาผลาญหลายอย่างเป็นปฏิกิริยารีดอกซ์ ออกซิเจนจะถ่ายเทออกซิเจนอย่างน้อยหนึ่งอะตอมไปยังสารตั้งต้น - การโอน
Transferases จะถ่ายโอนกลุ่มฟังก์ชันจากวัสดุพิมพ์หนึ่งไปยังอีกวัสดุหนึ่ง หมู่ฟังก์ชันคือกลุ่มอะตอมในสารประกอบอินทรีย์ที่กำหนดคุณสมบัติของสารและพฤติกรรมการเกิดปฏิกิริยาในระดับมาก สารประกอบทางเคมีที่มีหมู่ฟังก์ชันเดียวกันจะถูกจัดกลุ่มเป็นชั้นของสารเนื่องจากคุณสมบัติที่คล้ายคลึงกัน กลุ่มการทำงานจะถูกแบ่งออกตามว่าเป็นกลุ่มที่แตกต่างกันหรือไม่ เฮเทอโรอะตอมเป็นอะตอมในสารประกอบอินทรีย์ที่ไม่ใช่คาร์บอนหรือไฮโดรเจน
เช่น -OH -> กลุ่มไฮดรอกซิล (แอลกอฮอล์) - ไฮโดรเลส
ไฮโดรเลสแยกพันธะในปฏิกิริยาย้อนกลับโดยใช้น้ำ เอสเทอร์เอสเทอร์เปปไทด์ไกลโคไซด์กรดแอนไฮไดรด์หรือพันธะ C-C ปฏิกิริยาสมดุลคือ A-B + H2O? A-H + B-OH.
เอนไซม์ที่อยู่ในกลุ่มของไฮโดรเลส ได้แก่ alpha galactosidase - ไลแอส
Lyases หรือที่เรียกว่า synthases กระตุ้นความแตกแยกของผลิตภัณฑ์ที่ซับซ้อนจากพื้นผิวที่เรียบง่ายโดยไม่ต้องแยก ATP ออก รูปแบบปฏิกิริยาคือ A-B → A + B
ATP คืออะดีโนซีนไตรฟอสเฟตและนิวคลีโอไทด์ซึ่งประกอบด้วยไตรฟอสเฟตของอะดีโนซีนนิวคลีโอไซด์ (และเป็นส่วนประกอบของกรดนิวคลีอิกอาร์เอ็นเอที่อุดมด้วยพลังงาน) อย่างไรก็ตาม ATP ส่วนใหญ่เป็นรูปแบบสากลของพลังงานที่ใช้ได้ทันทีในทุกเซลล์และในขณะเดียวกันก็เป็นตัวควบคุมที่สำคัญของกระบวนการจัดหาพลังงาน หากจำเป็น ATP จะถูกสังเคราะห์ใหม่จากแหล่งเก็บพลังงานอื่น ๆ (ครีเอทีนฟอสเฟตไกลโคเจนกรดไขมัน) โมเลกุลของ ATP ประกอบด้วยกากอะดีนีนน้ำตาลไรโบสและฟอสเฟตสามตัว (? ถึง?) ในเอสเทอร์ (?) หรือพันธะแอนไฮไดรด์ (? และ?) - ไอโซเมอเรส
ไอโซเมอร์เร่งการแปลงทางเคมีของไอโซเมอร์ Isomerism คือการเกิดขึ้นของสารประกอบทางเคมีสองชนิดหรือมากกว่าที่มีอะตอมเดียวกัน (สูตรเชิงประจักษ์เดียวกัน) และน้ำหนักโมเลกุลซึ่งแตกต่างกันในการเชื่อมต่อหรือการจัดเรียงเชิงพื้นที่ของอะตอม สารประกอบที่เกี่ยวข้องเรียกว่าไอโซเมอร์
ไอโซเมอร์เหล่านี้แตกต่างกันในทางเคมีและ / หรือทางกายภาพและมักมีคุณสมบัติทางชีวเคมีด้วย Isomerism เกิดขึ้นกับสารประกอบอินทรีย์เป็นหลัก แต่ยังรวมถึงสารประกอบโคออร์ดิเนชัน (อนินทรีย์) ด้วย ไอโซเมอริซึมถูกแบ่งออกเป็นพื้นที่ต่างๆ - ลิกาส
Ligases เร่งการก่อตัวของสารที่มีความซับซ้อนทางเคมีมากกว่าสารตั้งต้นที่ใช้ แต่ในทางตรงกันข้ามกับไลเอสจะมีฤทธิ์ทางเอนไซม์กับ ATP การก่อตัวของสารเหล่านี้จึงต้องใช้พลังงานซึ่งได้มาจากการแยก ATP
เอนไซม์บางชนิดสามารถกระตุ้นปฏิกิริยาได้หลายอย่างบางครั้งก็แตกต่างกันมาก หากเป็นกรณีนี้พวกมันจะถูกกำหนดให้กับคลาสเอนไซม์หลายตัว
คุณอาจสนใจบทความเหล่านี้:
- อัลฟา - กลูโคซิเดส
- ไลเปส
- ทริปซิน
การจำแนกตามโครงสร้างของเอนไซม์
เอนไซม์เกือบทั้งหมดเป็นโปรตีนและสามารถจำแนกได้ตามความยาวของห่วงโซ่โปรตีน:
- โมโนเมอร์
เอนไซม์ที่ประกอบด้วยห่วงโซ่โปรตีนเพียงเส้นเดียว - โอลิโกเมอร์
เอนไซม์ที่ประกอบด้วยโซ่โปรตีนหลายตัว (โมโนเมอร์) - โซ่หลายเอนไซม์
เอนไซม์รวมหลายชนิดที่ทำงานร่วมกันและควบคุมซึ่งกันและกัน โซ่ของเอนไซม์เหล่านี้กระตุ้นให้เกิดขั้นตอนต่อเนื่องในการเผาผลาญของเซลล์
นอกจากนี้ยังมีโซ่โปรตีนแต่ละชนิดที่มีกิจกรรมของเอนไซม์หลายชนิดสิ่งเหล่านี้เรียกว่าเอนไซม์มัลติฟังก์ชั่น
การจำแนกตามปัจจัยร่วม
การจำแนกประเภทอื่นคือการจำแนกตามการพิจารณาปัจจัยร่วม ปัจจัยร่วมโคเอนไซม์และสารตั้งต้นเป็นชื่อของการจำแนกประเภทต่างๆของสารที่มีอิทธิพลต่อปฏิกิริยาทางชีวเคมีผ่านการมีปฏิสัมพันธ์กับเอนไซม์
ถือว่าโมเลกุลและไอออนอินทรีย์ (ส่วนใหญ่เป็นไอออนของโลหะ)
เอนไซม์โปรตีนบริสุทธิ์ประกอบด้วยโปรตีนโดยเฉพาะและศูนย์กลางที่ใช้งานนั้นเกิดขึ้นจากกากกรดอะมิโนและกระดูกสันหลังของเปปไทด์เท่านั้น กรดอะมิโนเป็นกลุ่มของสารประกอบอินทรีย์ที่มีหมู่คาร์บอกซี (-COOH) อย่างน้อยหนึ่งกลุ่มและกลุ่มอะมิโนหนึ่งกลุ่ม (-NH2)
โฮโลเอนไซม์ประกอบด้วยส่วนประกอบของโปรตีนเอโพเอนไซม์และปัจจัยร่วมซึ่งเป็นโมเลกุลที่มีน้ำหนักโมเลกุลต่ำ (ไม่ใช่โปรตีน) ทั้งสองอย่างรวมกันมีความสำคัญต่อการทำงานของเอนไซม์
โคเอนไซม์
โมเลกุลอินทรีย์เป็นปัจจัยร่วมเรียกว่าโคเอนไซม์ หากโควาเลนต์ผูกพันกับเอโพเอนไซม์จะเรียกว่ากลุ่มเทียมหรือสารตั้งต้นร่วม กลุ่มขาเทียมหมายถึงส่วนประกอบที่ไม่ใช่โปรตีนอย่างแน่นหนา (ส่วนใหญ่เป็นโควาเลนต์) ที่เชื่อมโยงกับโปรตีนที่มีฤทธิ์เร่งปฏิกิริยา
Cosubstrates เป็นชื่อของการจำแนกประเภทต่างๆของสารที่มีอิทธิพลต่อปฏิกิริยาทางชีวเคมีผ่านการมีปฏิสัมพันธ์กับเอนไซม์ ในฐานะที่เป็นตัวเร่งปฏิกิริยาทางชีวภาพโมเลกุลจะเร่งปฏิกิริยาในสิ่งมีชีวิตเอนไซม์จะเร่งปฏิกิริยาทางชีวเคมี พวกเขาลดพลังงานกระตุ้นที่ต้องเอาชนะเพื่อให้สามารถเปลี่ยนสารได้